¿Qué significa la bioequivalencia de un medicamento genérico?
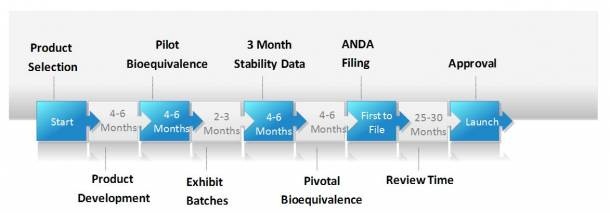
Cuando hablamos de medicamentos genéricos, uno de los conceptos más importantes a tener en cuenta es el de bioequivalencia. Este término demuestra la intercambiabilidad entre el medicamento genérico y el medicamento innovador desde el punto de vista de la calidad, seguridad y eficacia. Los estudios de bioequivalencia se realizan para demostrar que el medicamento genérico es equivalente e intercambiable con el medicamento innovador en términos de eficacia terapéutica.
Cuando dos medicamentos son equivalentes en la velocidad y cantidad del fármaco activo que se absorbe y llega al tejido o área donde se produce su efecto, los dos fármacos son terapéuticamente equivalentes y pueden usarse indistintamente. Es decir, si se produce la “equivalencia farmacocinética” se asume que la misma equivalencia existirá en el plano farmacodinámico y, lo que es más importante, en su eficacia y seguridad .
Bioequivalencia: criterios.
Los criterios para realizar estudios de biodisponibilidad son muy estrictos e incluyen los nueve componentes que se exponen a continuación.
- Diseño detallado del estudio (protocolo)
- Presentación y aprobación del protocolo por un Comité Ético
- El suficiente número de voluntarios para asegurar que el estudio es capaz de demostrar diferencias significativas
- Reconocimientos médicos completos de los voluntarios antes, durante y después del estudio
- Generalmente se realiza un estudio cruzado, es decir, que todos los voluntarios reciben tanto el producto de referencia como el genérico con un “periodo de lavado” entre ambos
- Los voluntarios son seleccionados al azar para recibir primero, bien el producto de referencia o bien el producto genérico
- Cumplimiento de las buenas prácticas clínicas (GCP) y de las buenas prácticas de laboratorio (GLP)
- Condiciones estandarizadas del estudio (por ejemplo, composición y horario de las comidas)
- Periodos de “lavado” suficientemente amplios entre los ensayos
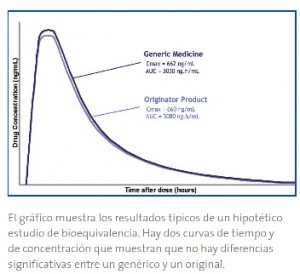
Hay que hacer especial hincapié en desterrar un famoso mito que se refiere a que muchas personas piensan que existe una diferencia del 20% de concentración o principio activo del fármaco genérico respecto del original. El famoso 20% no significa que exista esa variabilidad en la eficacia del medicamento, ni tampoco en el contenido real de principio activo, sino que hay un 20% de variabilidad en la absorción del fármaco.
El hecho real es que la biodisponibilidad de cualquier principio activo varía entre los diferentes individuos e incluso entre los diferentes lotes de un medicamento – incluidos los de marca. Téngase en cuanta que esta variación farmacocinética – que no de principio activo – del 20%, se puede dar entre dos lotes diferentes de la misma marca.
En una reciente declaración de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), la institución encargada de la aprobación y la supervisión de todos los medicamentos, se afirmaba que “genéricos e innovadores no difieren en cuanto a las garantías de calidad” que tienen que elevar a los organismos reguladores.