El ciclo del medicamento
Los medicamentos son evaluados, regulados y controlados a lo largo de todo su ciclo de vida por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
Cuando acudimos a la farmacia en busca de un medicamento concreto, generalmente, no nos paramos a pensar qué hay detrás de ese fármaco. Como cualquier producto sanitario, desde su creación hasta su comercialización, existe un riguroso proceso de desarrollo y regulación que podría denominarse ‘Ciclo del medicamento’.
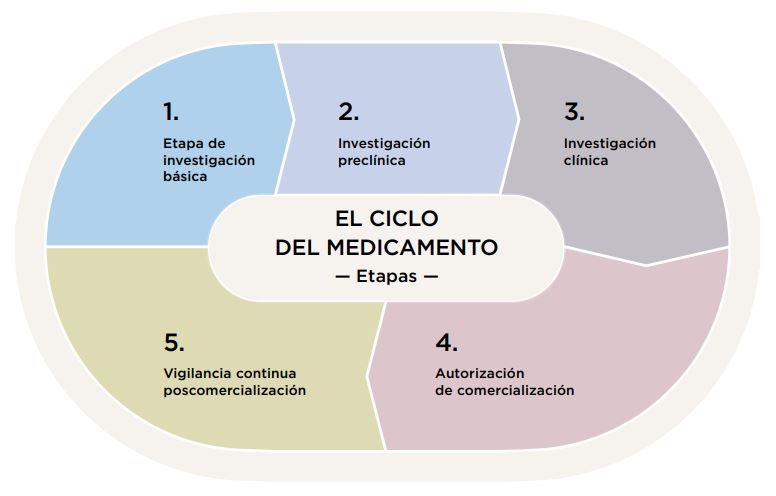
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) recoge en su guía ‘Cómo se regulan los Medicamentos y Productos Sanitarios en España’ este ciclo de vida de los fármacos que, como podéis ver en la siguiente infografía, cuenta con cinco etapas: investigación básica, investigación preclínica, investigación clínica, autorización de comercialización y vigilancia continua poscomercialización.
Fuente: Tabla extraída de la guía ‘Cómo se regulan los Medicamentos y Productos Sanitarios en España’
La AEMPS se encarga de evaluar cada medicamento y otorgarle la autorización de comercialización en base a su cumplimiento de los criterios de calidad, seguridad y eficacia. Además, los fármacos autorizados no están exentos de vigilancia y tienen la obligación de notificar cualquier modificación que se produzca para nuevamente obtener el visto bueno.
Para conocer si un medicamento está o no autorizado se puede consultar el Centro de Información online de Medicamentos de la AEMPS (CIMA), que ofrece una información permanentemente actualizada de todos los medicamentos autorizados por la AEMPS.
Investigación y autorización de medicamentos
Las etapas de investigación por las que pasa un medicamento son tres y tienen como objetivo demostrar la calidad, eficacia y seguridad del medicamento.
Las fases de la investigación con medicamentos abarcan la investigación básica, los ensayos preclínicos, y los ensayos clínicos en humanos y animales. Cualquier ensayo clínico tiene que ser autorizado por la AEMPS antes de su realización.
- Investigación básica: implica procesos como la identificación de candidatos, su síntesis, caracterización, rastreo y pruebas de eficacia terapéutica.
- Estudios preclínicos: estos estudios pretenden conocer los efectos del medicamento a distintas dosis en diferentes órganos y sistemas, o cómo se va a distribuir o eliminar el medicamento en el organismo.
En su conjunto, el periodo de tiempo requerido en las etapas de investigación básica y preclínica es de unos 6 años.
- Ensayos clínicos: permite conocer el comportamiento del medicamento en las personas a las que va destinado y si consigue realmente eficacia en el tratamiento de la enfermedad para la que se dirige con un perfil aceptable de reacciones adversas.
La autorización de medicamentos
Desde la Asociación Española de Medicamentos Genéricos, AESEG, con nuestro reciente post ‘Regulación y autorización de medicamentos en España’, hemos tratado de acercaros cuáles son los procedimientos posibles para que las farmacéuticas consigan la comercialización de un medicamento.
Hay que destacar que la AEMPS establece distintos procedimientos a la hora de llevar a cabo la autorización de fármacos y que los criterios técnicos que sigue son comunes en la UE.







